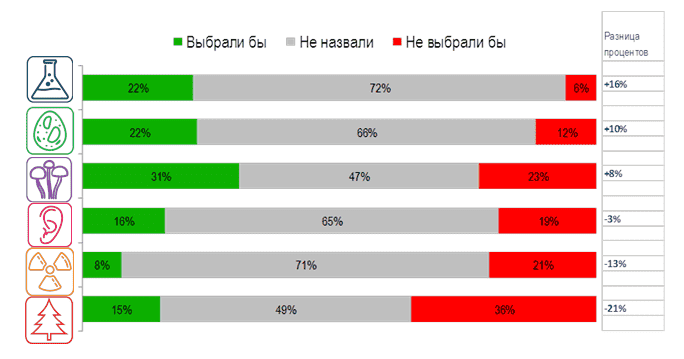
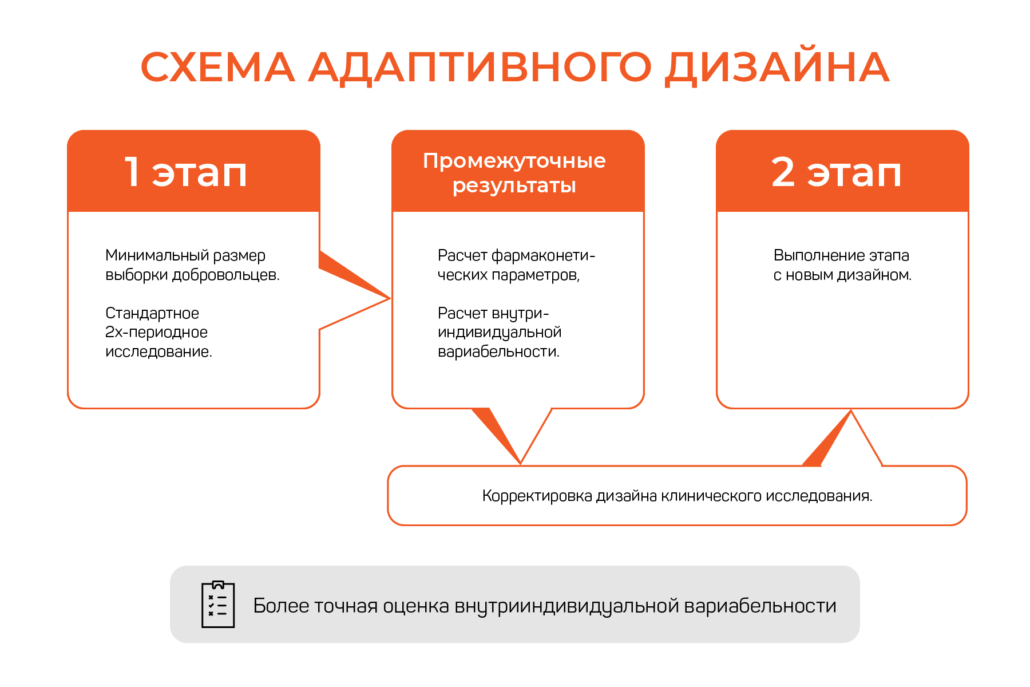
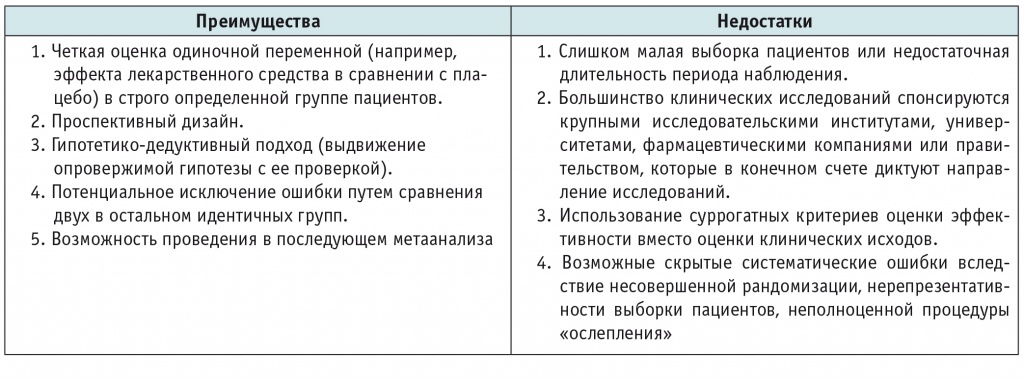
Дизайне исследования - Виды клинических исследований лекарственных средств
Дизайны клинических испытаний
Клиническое исследование — научное исследование, которые необходимо провести в процессе разработки лекарственного препарата перед его выводом в продажу. Исследование состоит из 4 основных этапов, описанных в соответствующем документе. Протокол клинического исследования лекарственного препарата — документ, в котором содержатся инструкции для всех участников, с описанием задач и указаниями по их выполнению.
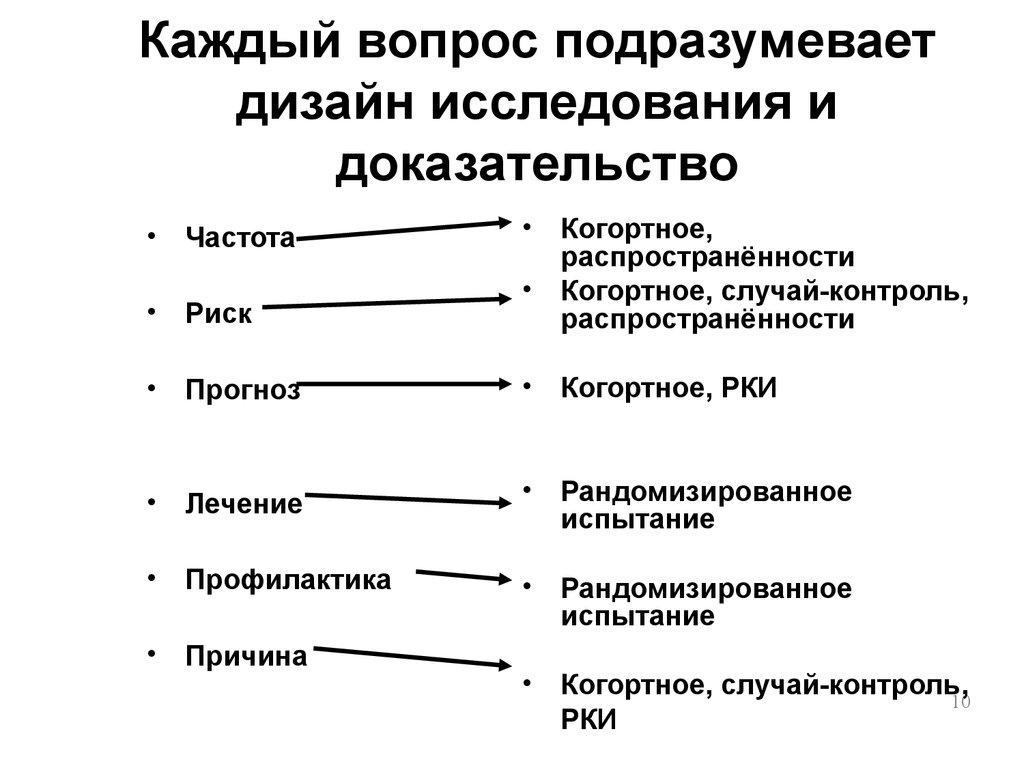

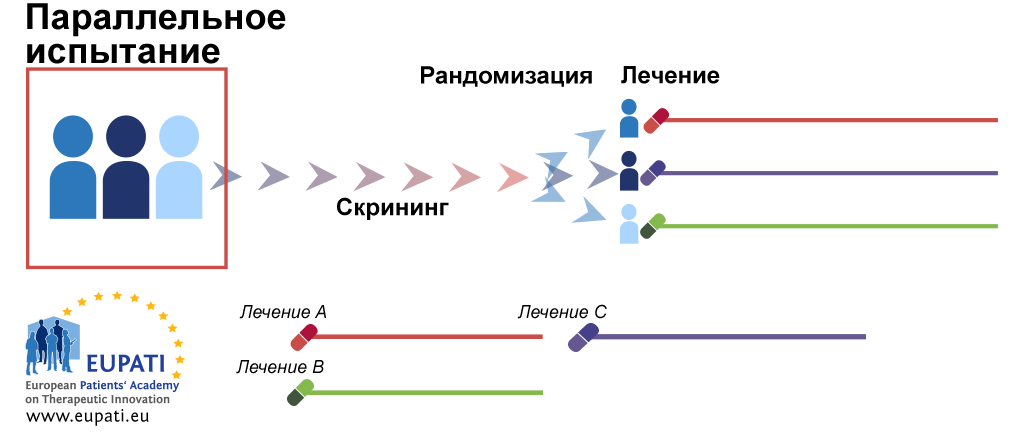
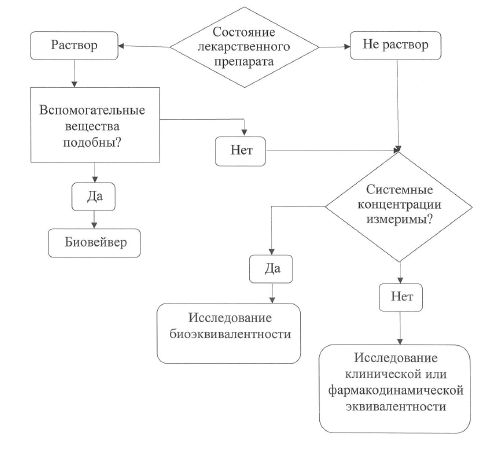


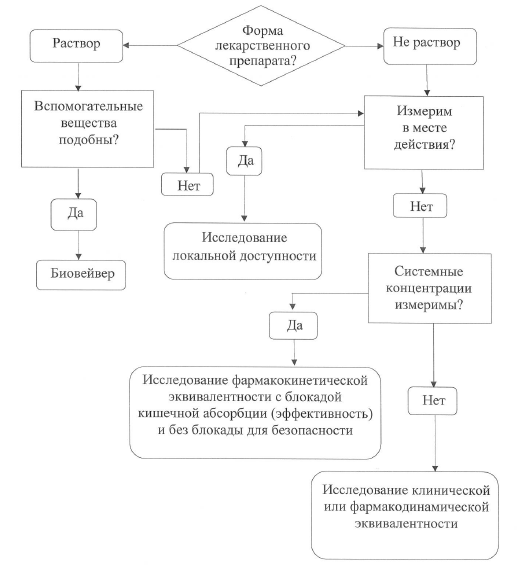


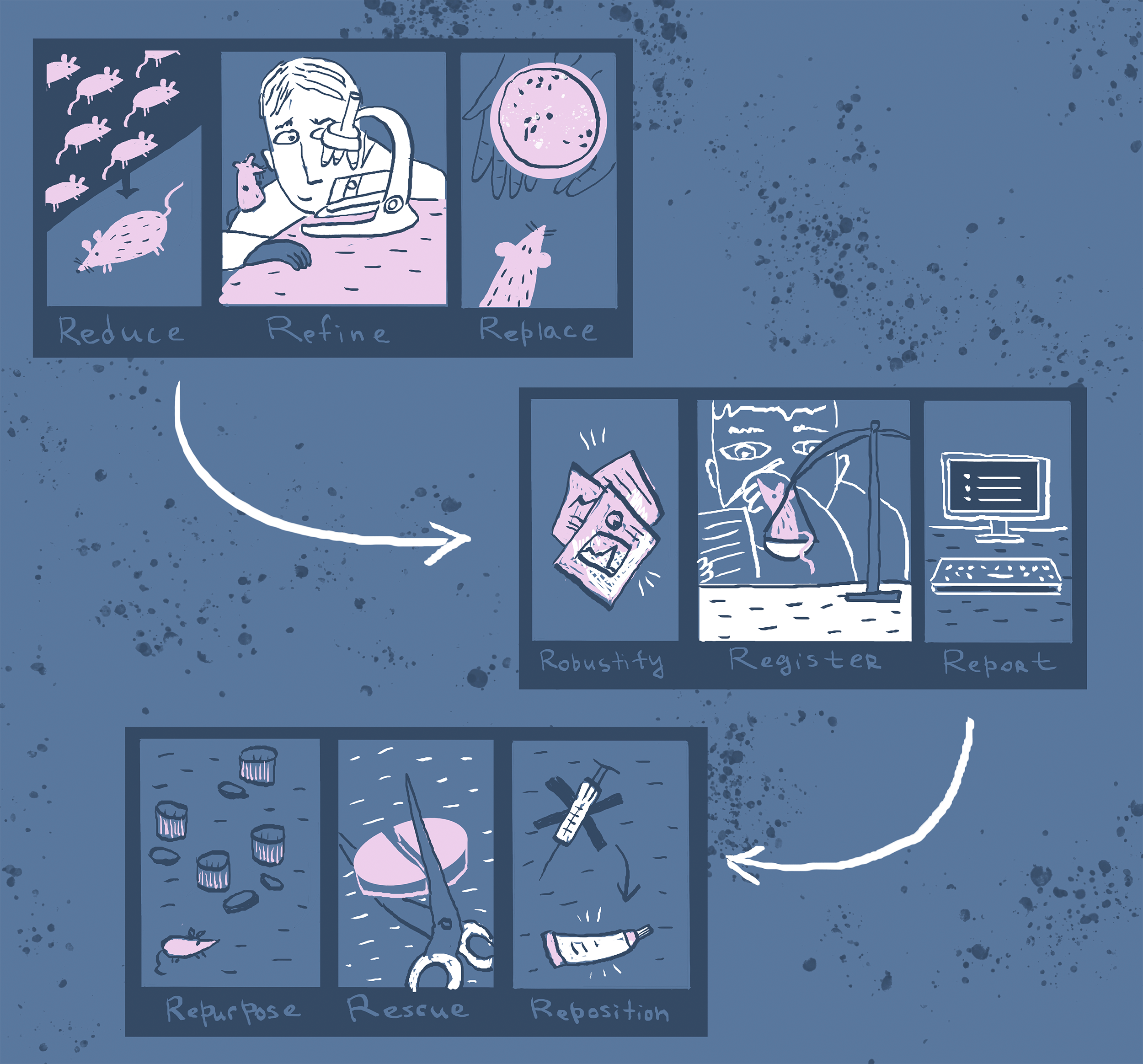
Исследования и разработки в области лекарственных средств. Существует несколько типов дизайна клинических испытаний. Их можно классифицировать следующим образом:. В нерандомизированных контролируемых клинических испытаниях исследователь распределяет участников в группы лечения и контрольные группы. В этих испытаниях контрольные группы могут быть параллельными или историческими. В случае использования исторического контроля все пациенты в испытании получают исследуемый лекарственный препарат ; результаты сравниваются с предыдущим состоянием пациента например, у пациента с хроническим заболеванием или с контрольной группой предыдущего исследования.
- Планирование исследований в медицинской сфере называют дизайном исследования — набор методов и процедур, используемых для сбора и анализа данных по переменным, указанным в конкретном вопросе исследования. Дизайн исследования, созданный для ответа на конкретный вопрос, зависит от задач исследования и доступности ресурсов.
- Информационно-правовая система нормативных правовых актов Республики Казахстан.
- Ассоциация организаций по клиническим исследованиям AOKИ — некоммерческая организация, объединяющая юридических лиц, участников российского рынка клинических исследований. Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря г.
- DOI: Наркевич А.
- Клиническое исследование — научное исследование эффективности, безопасности и переносимости медицинской продукции в том числе лекарственных средств у людей.
- Дизайн клинических исследований испытаний выстраивается перед написанием подробного протокола исследования в зависимости от его ключевой цели. Наиболее распространенные варианты дизайна следующие:.


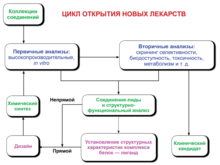
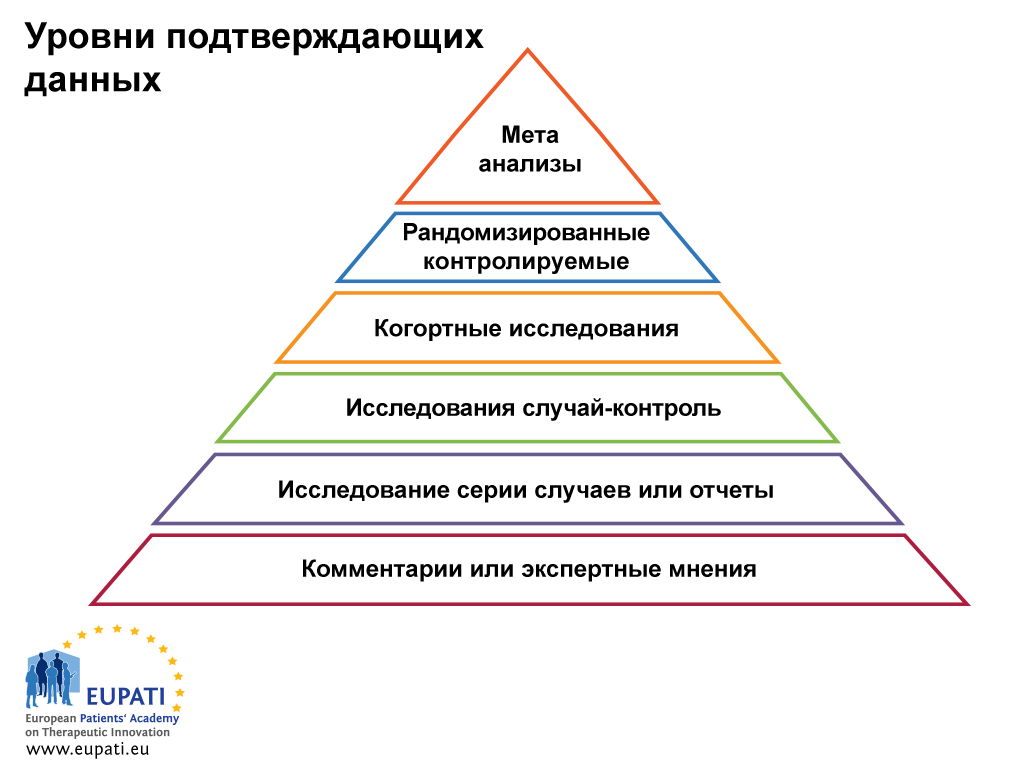







Клинические исследования лекарственного средства являются необходимым этапом разработки любого нового препарата, или расширения показаний для применения лекарственного средства, уже известного врачам. На начальных этапах разработки лекарственных средств проводятся химические, физические, биологические, микробиологические, фармакологические, токсикологические и другие исследования на тканях in vitro или на лабораторных животных. Это так называемые доклинические исследования , целью которых является получение научными методами оценок и доказательств эффективности и безопасности лекарственных средств. Однако эти исследования не могут дать достоверной информации о том, как изучаемые препараты будут действовать у человека, так как организм лабораторных животных отличается от человеческого и по фармакокинетическим характеристикам и по реакции органов и систем на лекарства. Поэтому необходимо проведение клинических испытаний лекарственных средств у человека.